O que é Química Geral?

A Química Geral é a base de muitas outras disciplinas químicas, sendo fundamental para quem deseja compreender de maneira mais profunda os processos e reações químicas que ocorrem em nosso dia a dia. Ela serve como alicerce para áreas mais avançadas da Química, como Química Orgânica, Inorgânica, Físico-Química e Bioquímica. O primeiro contato de todos com a química geral é através do ensino médio, com conceitos de modelo atômico, ligações químicas, elementos da tabela periódica, mas que muitas vezes são apresentados só para cumprir currículo, despertando pouco interesse pela área.
Visando introduzir os conceitos básicos de química, ela vem para nivelar todos os estudantes de forma que não comprometa o aprendizado futuro, diferente do abordado no ensino médio, no nível superior os conceitos são melhor abordados de forma profunda e detalhada de modo que pensamentos iniciais do que era um átomo para os gregos e do que é um átomo atualmente descrito pela mecânica aciona um fascínio pela área nunca visto.
Introduzindo a química
Através da química geral se torna fácil entender a evolução da química desde o pensamento grego que introduzia a ideia de divisão da matéria a ponto em que restaria somente um fragmento, esse que não poderia ser dividido “átomo”, e com os avanços dos alquimistas que purificavam materiais da natureza para uso em experimentos com um objetivo diferente do da química atual, mas que motivou outros a pensar ‘por que ao mergulhar uma barra de chumbo em uma solução de ouro dissolvido em água-régia o chumbo virava ouro.?’
Os avanços seguem na tentativa de explicar o que são esses objetos invisíveis que podem ser transformados em outras coisas, e com avanços nas pesquisas de John Dalton defendendo a ideia de átomo e posterior experimento de J. J Thomson mais de século depois, mostrando ao mudo que sim átomos são divisíveis e compostos por elétrons e uma densidade positiva e homogênea que permeava esses elétrons, para depois vir Rutherford e mostrar ao mundo que átomos são um grande vazio denso no centro (núcleo) e com nuvens de elétrons ao redor, mas ainda faltava algo porque esses elétrons não colapsavam no núcleo se Maxwell já demonstrou com as equações do eletromagnetismo, que partículas com carga que estão aceleradas emitem radiação, e a partir da quantização de Bohr do átomo de hidrogênio, descrevendo com a mecânica quântica que os elétrons só podem assumir orbitas específicas a uma dada distância dos núcleos e que esses só poderiam assumir quantidades discretas de energia nessas ‘orbitas’, finalmente foi possível descrever as observações sobre espectro de emissão dos elementos químicos.
Assim a mecânica quântica trouxe mais luz para o entendimento do modelo moderno de átomo, e através das equações de Schrödinger o conceito de orbitais atômicos foi consolidado e de que tudo na química é regido pela interação entre esses objeto. A partir daí a ciência avança no entendimento das ligações químicas com a TLV (Teoria da ligação de valência) e nas novas teorias de orbitais moleculares (TOM) descrevendo como moléculas são formadas e estabilizadas e como a partir disso ligações podem ser quebradas e criadas, aprimorando as área conhecida como química orgânica, possibilitando aumento da complexidade molecular, novas técnicas para se quantificar amostras foram desenvolvidas como a espectroscopia de absorção atômica e molecular.
E a química geral continua avançando mostrando a todos como a ciência evolui e que tudo foi desenvolvido e aprimorado com o trabalho de inúmeras pessoas que pavimentaram até hoje. Após isso conceitos de ácidos e bases são abordados, de termodinâmica de reações químicas, cinética de reações, nomenclatura de compostos orgânicos e inorgânicos, e tipos de reações: separadas em:
Reações acido-base:
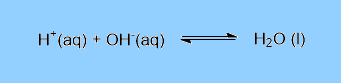
Reações de precipitação:

Reações de oxirredução:

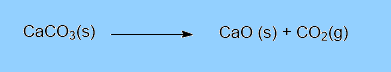
Reações de desprendimento de gás:
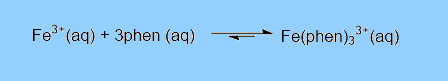
Reações de complexação:
E a partir delas todas a reações podem ser descritas.
Inter-relação com as outras áreas
Como a química geral é a base para ingresso em áreas mais específicas, ela se conecta com todas, e os conceitos vistos nesse momento serão retomados e abordados no contexto aplicável para aquela área. Como a química inorgânica, que reintroduz o conceito de orbitais, acidez e basicidade agora com descrito pela ideia de bases e ácidos moles e duros, relacionando a carga de um íon com seu raio e descrevendo interações que afetarão a estabilidade cinética e termodinâmica dos compostos de coordenação. Na química orgânica acidez e basicidade retorna, pois todas as reações orgânicas são reações ácido/base dessa forma esse conceito auxilia no entendimento de direções de reações e o conceito de orbitais moleculares descreve como essas moléculas interagem durante uma reação, por que determinados compostos priorizam um produto em detrimento de outro?. Na bioquímica ela retorna com os conceitos de termodinâmica e direcionamento de reações pela energia livre de Gibbs, com mecanismos de catálise e os conceitos de tipos de ligações químicas, como as ligações covalentes, ligações iônicas, ligações fracas como Van der Waals, dipolo-dipolo, dipolo induzido.
Com isso a química geral é fundamental nos cursos de química mesmo que os mesmos conceitos sejam retomados nas demais áreas, uma base sólida sempre facilita o caminho para o aprendizado em qualquer coisa, e muitas vezes dois professores podem explicar o mesmo de forma diferente e o que antes não era fácil de entender em outro as peças se encaixam e consolidam o seu conhecimento na área.
